Neuroinmunorregulación
Neuroinmunorregulación
La biología molecular representa una herramienta clave
en el estudio y comprensión de la neuroinmunorregulación,
ya que interviene en una amplia gama de procesos
biológico-moleculares, en donde hay mediadores que
participan en la comunicación entre el sistema nervioso
central (SNC) y el sistema inmunológico (SI), proceso
bidireccional regulado por el eje hipotálamo-hipófi sisadrenales.
Hay múltiples conexiones anatómicas y fi siológicas
entre el SNC y el SI, las cuales incluyen el “cableado” del
sistema nervioso autónomo (SNA) a través de la estimulación
del nervio vago y fi bras nerviosas simpáticas hacia
órganos del SI, como bazo, médula ósea, timo y ganglios
linfáticos, aparato gastrointestinal y piel.1
Los dos sistemas (SNC y SI) comparten múltiples mensajeros
químicos, que incluyen desde pequeñas moléculas
como el factor liberador de corticotropina (CRF) hasta
grandes proteínas, como citocinas, neurotransmisores,
neuropéptidos y factores de crecimiento.1-3 El SI envía
señales hacia el cerebro para responder al daño causado
por virus, bacterias y parásitos por medio de un elaborado
sistema de información bidireccional. La relación
entre el cerebro y el SI se realiza a través de la barrera
hematoencefálica (BHE), la cual funciona como un “fi ltro”
de moléculas solubles entre ambos sistemas.2,3
ANTECEDENTES
La interacción entre el sistema inmunológico, el sistema
endocrino y el sistema nervioso fue descubierta por Hans
Selye en la Universidad de McGill a mediados del decenio
de 1930.
Selye demostró que ciertos estímulos de tipo físico,
químico, biológico y emocional, administrados a las
ratas, eran capaces de activar el eje hipotálamo-hipófisisadrenales
Para muchos de los científi cos precursores en el campo
de la psiconeuroinmunología (PNI) ha representado
un reto convencer a los inmunólogos tradicionalistas y a
los neurocientífi cos que la PNI es una ciencia real y que
ha mostrado avances impresionantes en los últimos 20
años, ayudando a comprender las complejas interacciones
entre estos sistemas.5
La comunicación entre estos sistemas (el SNC y el SI)
incluye un fl ujo recíproco de información, en donde las
citocinas liberadas por macrófagos activados y por monocitos
durante procesos infecciosos tienen como “blanco
neural” la regulación de la termogénesis, los cambios en
el comportamiento, el sueño, cambios de estados de ánimo,
entre otros.6 Dentro del sistema nervioso central, se
ha podido detectar la producción de citocinas como resultado
de daño en el cerebro, durante infecciones virales y
bacterianas y en procesos neurodegenerativos.6,7
SI envía señales hacia el cerebro para responder al
daño causado por virus, bacterias y parásitos por medio
de un elaborado sistema de información bidireccional.
La relación entre el cerebro y el SI se realiza mediante
una “ventana” en la barrera hematoencefálica; está constituida
por los órganos circunventriculares, que incluyen
a la glándula pineal, el órgano subfornical, la eminencia
media, el lóbulo neural de la hipófi sis, el área postrema,
el órgano subcomisural y el órgano vasculoso de la lámina
terminal.2,3
Los órganos circunventriculares permiten la transmisión
de mediadores solubles liberados por el sistema
inmunológico para arribar a sitios específi cos en el hipotálamo
así como en otras áreas del SNC (fi g. 12-1).1
Las vías a través de los sistemas endocrino y nervioso
autónomo (de manera primaria sistema nervioso
simpático o SNA) permiten la llegada de moléculas biológicamente
activas (hormonas, neurotransmisores, neuropéptidos
y citocinas) que interactúan con células del
SI (linfocitos, macrófagos, células epiteliales y células
dendríticas, entre otras) a través de receptores en estas
células inmunocompetentes.2,8,9
Los linfocitos T y B, los monocitos/macrófagos, los
linfocitos citolíticos naturales y los granulocitos poseen
receptores para hormonas, neurotransmisores y neuropéptidos,
entre los que se incluyen epinefrina (EPI),
norepinefrina (NE), dopamina (DA), histamina, acetilcolina
(Ach), sustancia P (SP), prostaglandinas (PG), somatostatina
(SOM), péptido intestinal vasoactivo, prolactina
(PRL), hormona de crecimiento (GH), corticosterona,
testosterona, factor liberador de corticotropina (CRF),
ACTH, péptidos opioides endógenos como endorfi na β
y hormona estimulante de los melanocitos α (α-MSH)
entre otros.2 La interacción entre factores neuroendocrinos
y sus receptores en células inmunocompetentes
puede alterar la actividad celular a través de la activación
de sistemas de segundos mensajeros que incluyen al
AMPc.2 De manera alternativa, factores neuroendocrinos
pueden regular respuestas inmunes, afectando la síntesis
y liberación de ciertos mediadores, como linfocinas y
monocinas.2
Además de la actividad del sistema nervioso simpático
(SNS), el SI es infl uido por el sistema neuroendocrino
a través del eje hipotálamo-hipófi sis-adrenales (fi g.
12-1). Aunque el CRF y la ACTH ejercen un efecto de
tipo “regulador” directo sobre el SI, in vivo los mayores
efectos se ejercen a través de interacciones con otras
hormonas y productos del mismo SI, como es el caso de
la urocortina, que es un neuropéptido relacionado con
CRF; la urocortina participa en el control neural de funciones
inmunes periféricas.2
El eje hipotálamo-hipófi sis-adrenales se activa durante
infecciones virales y bacterianas, lo que resulta en un
importante incremento de los niveles hormonales (incluidos
los glucocorticoides), de mediadores inmunológicos
y de neuropéptidos y neurotransmisores.2,10,11 Aunque
se ha demostrado un papel predominante del hipotálamo
en las respuestas del SNC hacia el SI, se ha propuesto
que estructuras límbicas y la neocorteza también pueden
tener infl uencia sobre la respuesta inmune, se ha
demostrado que ciertas lesiones (por lo general de sistema
límbico) producen un aumento de una gran variedad
de mediadores inmunológicos, por ejemplo, lesiones en
la amígdala y en el hipocampo de la rata incrementan el
número de timocitos.2,3 Un estímulo eléctrico por cuatro
días directamente en el hipocampo aumenta el número
de neutrófi los y el índice fagocítico, y al mismo tiempo
reduce el número de linfocitos y los niveles circulantes
de corticosterona en ratas.2,3 Lesiones con ácido caínico
en el hipocampo aumentan la secreción de IgM e IgG en
respuesta a una estimulación con ovoalbúmina.3
Las citocinas se han considerado mediadores de
comunicación intracelular y extracelular;3 son potentes
reguladores de los sistemas hipotalámicos neuropeptidérgicos
que mantienen la homeostasia neuroendocrina
y regulan respuestas al estrés.10-14 Una rápida inducción
de citocinas, quimiocinas y PG es esencial para generar
una potente respuesta por parte del SI.14 Dentro de
las citocinas incluidas en este proceso se encuentran el TNF-α, las IL-1β, IL-6, IL-10, IL-12, IL-15, IL-17, IL-18,
y los interferones (IFN) tipo I (IFN-α e IFN-β) y tipo II
(IFN-γ) como potentes reguladores de respuestas en el
sistema neuroendocrino,3,14 aunque en la actualidad se
ha demostrado que el TNF-α, la IL-1β, la IL-6 y el IFN-γ
son rápidamente inducidos en respuesta a procesos
neuroinfl amatorios.3,14,15 El proceso de infl amación dentro
del SNC abarca una amplia variedad de procesos y
vías de señalización. Las catecolaminas como NE y EPI
están implicadas como importantes reguladores inmunológicos
eferentes después de la exposición a un estresante
o a daño.16 Las catecolaminas regulan un amplio margen
de actividades de las células del SI, entre las que se
encuentran la proliferación celular, producción de citocinas,
producción y secreción de anticuerpos, actividades
líticas y de migración celular, entre otras. Además, se ha
detectado NE y EPI en linfocitos y en macrófagos (MQ)
después de un estímulo de activación.
IMPORTANCIA DE LAS CITOCINAS
EN EL MANTENIMIENTO
Y PROPAGACIÓN DE LA RESPUESTA
INMUNITARIA EN SISTEMA
NERVIOSO CENTRAL
Durante un proceso de infl amación o daño en el SNC,
la neuroglia es capaz de liberar citocinas a nivel central,
lo que activa a nivel periférico al linfocito T CD4+
circulante, facilitando su entrada a través de la barrera
hematoencefálica al SNC; el linfocito activo en SNC es
capaz de liberar mediadores inmunes que participan en
la neuroinfl amación; durante este proceso, las citocinas
periféricas penetran al cerebro a través de la barrera
hematoencefálica por mecanismos de transporte activo
o mediante estimulación del nervio vago; estas citocinas
pueden regular mecanismos cognitivos a través de vías
colinérgicas y dopaminérgicas.

Aplicaciones 2
¿Qué es la terapia génica?
La terapia génica es un área de la medicina genómica que
utiliza el arsenal de que dispone la biología molecular,
para introducir de manera dirigida copias sanas de genes
defectuosos en células específi cas del organismo y modifi
car el curso de la enfermedad.
¿Cómo trabaja la terapia génica?
Los investigadores han realizado varias estrategias para
corregir los genes defectuosos:
• Insertar el DNA complementario de un gen normal dentro
del genoma para reemplazar al gen no funcional.
• Intercambiar un gen anormal por uno normal por
recombinación homóloga.
• Reparar por mutación selectiva inversa el gen anormal,
para que regrese el gen a su función normal.
• La regulación de un gen puede ser alterada, sea
mediante encendido o apagado.
¿Qué estudia la terapia
génica?
La terapia génica estudia la inserción de un gen “normal”
para reemplazar un gen “anormal” (el gen causante de la
enfermedad). A la molécula portadora se le conoce como
un vector y se usa para enviar el gen terapéutico a las
células blanco del paciente.
¿Qué se usa como vector
en la terapia génica?
El vector utilizado con más frecuencia es un virus que ha
sido genéticamente modifi cado para llevar DNA normal
humano y que no puede replicarse de manera autónoma.
Los virus han desarrollado de manera natural la forma
de encapsular y entregar sus genes a células humanas,
pero en una forma patogénica. Los científi cos han utilizado
esta capacidad, y después de manipular el genoma
del virus han insertado genes terapéuticos con el fi n de
corregir la enfermedad y tomando control de la replicación
del vector viral.
¿Cuál es el estado actual en las
investigaciones de terapia génica?
La administración de fármacos y alimentos en Estados
Unidos (Food and Drug Administration [FDA]) es el
organismo encargado de aprobar cualquier producto que
salga a la venta y se utilice como terapia del gen humano.
Mucha de la terapia génica en este momento se encuentra
en fase experimental y no mucha ha demostrado éxito
en estudios clínicos. El primer estudio clínico de terapia
génica se realizó en 1990.
¿Por qué es importante conocer
de terapia génica?
La importancia de la terapia génica en México radica
fundamentalmente en dar a conocer estos avances a los
estudiantes de medicina y carreras del área de la salud
con el fi n de que conozcan esta nueva metodología. En el
área de investigación, es primordial informar a la comunidad
científi ca los adelantos logrados en esta área por
investigadores mexicanos en diversas áreas de la medicina.
Por último, resulta de gran trascendencia situar a la
comunidad científi ca, que nuestro país participa en esta
área tanto en proyectos preclínicos como en métodos clínicos
y en ambos con resultados alentadores.
La terapia génica puede defi nirse como la introducción
de cualquier ácido nucleico al interior de células eucariontes
(pero no a células germinativas) con el propósito
de alterar el curso de una alteración médica o bien corregir
un trastorno metabólico o genético. Originalmente,
la terapia génica se concibió de manera específi ca para
tratar trastornos monógenos (el defecto en un solo gen),
pero es claro ahora que un solo gen puede ser considerado
como un nuevo “agente farmacológico” para tratar
muchos tipos de alteraciones.
En los últimos 10 años, la idea inicial de terapia génica
se ha hecho real con 636 procedimientos clínicos en
el mundo en los cuales 3 496 pacientes están incluidos
y la mayoría se está llevando a cabo en Estados Unidos.1
Aunque las expectativas han excedido el éxito inicial de
este campo relativamente nuevo, se ha obtenido información
muy importante de métodos clínicos y preclínicos.
Aunque la terapia génica puede considerarse como una
ciencia joven, es muy relevante destacar que gracias a
los adelantos tecnológicos recientes ha logrado grandes
avances, por lo que podrá usarse para tratar una amplia
variedad de enfermedades.2 Este hecho se ha refl ejado en
los resultados prometedores que se mostraron en pacientes
afectados por el síndrome de inmunodefi ciencia combinada
grave ligada al X (SCID) y la hemofi lia B.3-5 Sin
embargo, es pertinente mencionar que hay varias barreras
que limitan el éxito de la terapia génica. El obstáculo
más difícil de resolver ha sido la incapacidad de transferir
efi cazmente el “gen terapéutico” a una célula blanco
dada o tejido, de suerte que una cantidad apropiada del
producto del gen se obtenga (por lo general una proteína),
y corrija la enfermedad. Esto se debe en parte a que las
células, órganos, o ambas cosas, han desarrollado mecanismos
poderosos para evitar la acumulación interna de
material genético extraño.2
Casi todos los esfuerzos en los sistemas desarrollados
de terapia génica en seres humanos se han enfocado
sólo a células somáticas, dado que hay un alto grado
de preocupación respecto a la posibilidad de introducir
material genético exógeno dentro de células germinativas.
No obstante eso, recientes trabajos han explorado la
posibilidad de transferir genes al útero de animales con
el objetivo de corregir anormalidades en el embrión.6,7
Estos datos requieren consideraciones más amplias, pero
sin lugar a dudas abren una gama extensa de posibilidades
terapéuticas.
Básicamente, los métodos para la transferencia clínica
de genes en células humanas se basan en tres estrategias
generales: ex vivo, in vivo e in situ. Por ejemplo,
los métodos ex vivo se basan en obtener principalmente
leucocitos del paciente, sembrarlos y estimular su crecimiento
en cultivo; entonces se introduce el material genético
y se mantienen las células en cultivo. Estas células
que ahora expresan el gen apropiado se inyectan de nuevo
en el hospedador afectado (fi g. 10-1). En contraste con
las técnicas in vivo, se evita este proceso previo de varias
fases, introduciendo de manera directa el gen terapéutico
en el torrente sanguíneo del hospedador, llegando así al
órgano específi co.2 La entrega in situ de genes se realiza
mediante el envío de un gen dado, el cual se inyecta de
manera directa en un vector apropiado, por ejemplo, en
el caso de tumores sólidos (cáncer de próstata).
EL HÍGADO COMO ÓRGANO BLANCO
El hígado posee una serie de características que lo hacen
atractivo para la terapia génica. Es un órgano en donde
las vías metabólicas esenciales tienen lugar y, por ende,
el hígado está afectado en muchas enfermedades metabólicas
congénitas. Debido a su particular posición con
respecto a la circulación del torrente sanguíneo, el hígado
puede funcionar como una glándula secretora para la
liberación de proteínas terapéuticas. Dada la estructura
peculiar del endotelio hepático, el parénquima hepático
es accesible a moléculas tan grandes como fragmentos
de DNA o virus recombinantes circulantes en el torrente
sanguíneo.
En el último decenio, se ha dado testimonio de la ejecución
de varios procedimientos para transferir genes.
Estrategias terapéuticas
para la fi brosis hepática
En teoría, los tratamientos antifi bróticos efi caces deben
satisfacer varios criterios importantes. Primero, cualquier
terapia debe tener una base biológica legítima, pero también
un tratamiento potencial ventajosamente farmacológico,
en el entendido de que los niveles de compuestos
activos han de llegar al hígado en concentraciones altas
y producir pocos efectos extrahepáticos. Por último, un
agente terapéutico debe permanecer en el micromedio
del tejido blanco por largos periodos.
Terapias actuales
No se ha establecido terapia defi nitiva alguna para la
cirrosis hepática. Sin embargo, recientes discernimientos
en la patogenia molecular de la fi brosis hepática y el
papel de las células estelares hepáticas activadas ofrecen
esperanzas para un futuro desarrollo de una terapia exitosa.
Avances en la tecnología
génica del vector
El principal impedimento en el desarrollo de la terapia
génica es la disponibilidad de sistemas de vectores efi caces
para enviar de manera dirigida un determinado gen.
Un vector ideal sería aquel que crece de modo efi ciente
en títulos altos en la célula blanco, y persiste in vivo sin
efectos secundarios tóxicos o inmunológicos. El desarrollo
de este vector ideal aún no se ha logrado y no es probable
que haya un solo vector satisfactorio para todo tipo
de aplicaciones en un futuro cercano. No obstante, hay
informes de una variedad de desarrollos interesantes por diferentes grupos que trabajan en terapia génica alrededor
del mundo. Ciertamente, se está avanzando rápido
en esta área biotecnológica. Hasta ahora, los retrovirus
continúan siendo ampliamente estudiados, debido a la
ausencia de inmunogenicidad y una capacidad única de
integrarse en los cromosomas de la célula hospedadora.
Casi todos los usos para los retrovirus son para enfermedades
hematopoyéticas, donde diferentes subfamilias de
retrovirus (oncovirus, lentivirus y retrovirus espumante)
(foamy) despliegan una variedad de habilidades capaces
de integrarse en las células progenitoras. El mejor ejemplo
exitoso de terapia génica humana (hasta la fecha)
continúa siendo el tratamiento de varios niños afectados
con el síndrome de inmunodefi ciencia combinada grave
(SCID-XI).12 Por otro lado, los vectores lentivirales se
vuelven cada vez más seguros y fáciles de usar. Líneas
celulares inducibles, con multicomponentes empacables,
permiten ahora la producción de preparados con títulos
altos de recombinantes con fenómenos de replicación
competente no detectables.13 Los sistemas lentivirales
ahora han aumentado su capacidad de clonación y despliegan
buena efi cacia para la integración en células que
no se están dividiendo, sobre todo en células progenitoras
hematopoyéticas tanto en adultos como in utero.
Los virus espumantes están recibiendo mayor atención,
debido a que despliegan una capacidad mayor de
clonación de cualquier subfamilia retroviral, en tanto que
se integran de manera efi ciente en las células hematopoyéticas
progenitoras.14
Los virus adenoasociados (AAV) son vectores que se
están convirtiendo rápido en uno de los sistemas más
usados. Estos vectores pueden crecer en títulos relativamente
altos y muy pocos despliegan efectos secundarios
inmunológicos. Los AAV han aumentado la esperanza de
una cura eventual para la hemofi lia, debido a su expresión
efi caz en hígado, según datos recientes de los grupos
de Kay y High.4,15 En un estudio inicial, se enviaron AAV
a músculo, produciendo niveles bajos de factor IX circulante.
Se están llevando a cabo nuevos estudios mediante
el envío de genes clonados en AAV hacia el hígado.
A pesar de las promesas de que los AAV evitan completamente
la respuesta citotóxica de las células T, está
claro que algunas combinaciones de transgenes y promotores
pueden llevar a problemas serios. Sin duda, ésta es
una barrera que hay que vencer en el futuro.
Los adenovirus han tenido diferentes grados de popularidad.
Los recientes fracasos del año 2001 en estudios
clínicos hacen preocupante su uso en lo que respecta a la
seguridad, aunque la opinión global sobre el uso de estos
vectores es que son muy útiles y se están volviendo más
benévolos. Los vectores adenovirales los utilizan ahora
muchos grupos alrededor del mundo participantes en la
ingeniería de vectores.1 Un hecho establecido es que los
vectores adenovirales tienen una gran cantidad de serotipos
diferentes y esto ha sido la clave que ha permitido un
gran progreso en la aplicación particular de serotipos y
proteínas de superfi cie blanco alteradas (funcionamiento
como ligandos) para evitar tipos de células específi cas.
Totalmente borrado o vacío de su contenido, el adenovirus
puede crecer en títulos extremadamente altos y
superar la mayoría de los problemas inmunitarios, aunque
se ha mostrado en fecha reciente que combinaciones
particulares de elementos del promotor del transgén
y ciertas alteraciones patológicas son capaces de sacar
anormalidades inmunitarias residuales.16,17 Los plásmidos
desnudos, el más simple de los vectores, se envían
cada vez de más maneras diferentes y en algunos casos
pueden igualar los niveles de transducción de los virus
como lo ha demostrado el grupo de Leaf Huang.18 Una
ventaja de los sistemas de envío de virus es que cada
vez más se incrementa la capacidad de traducir en la
célula blanco particular comparada con los sistemas no
virales. Sin embargo, crece la preocupación relacionada
con la seguridad de algunos virus, combinados con una
alta capacidad de envío de los vectores blanco no virales
(sobre todo a través de combinación con moléculas
del ligando); por último, esta ventaja puede ser cada vez
más obsoleta. Es difícil predecir el futuro que estas ventajas
pueden traer, pero es seguro que si la tecnología del
vector se desarrolló en un tiempo muy corto, nos pone
ahora más cerca de la realidad de terapia génica humana.
Además, la opción de vectores adecuados que llevan
genes terapéuticos depende de las necesidades individuales
de cada terapeuta génico. Como ya dijo, el diseño y la
ingeniería de un vector universal completamente seguro
todavía no se ha puesto en práctica.
Terapia génica en fi brosis hepática
Hay un número de publicaciones recientes que han usado
terapia génica para mejorar cirrosis en diferentes modelos
inducidos por varios agentes causales. Así, la introducción
del gen de la telomerasa se ha avocado en inhibir
y aun proteger en contra de la fi brosis hepática inducida
por CCl4 en ratones.19 Un grupo diferente ha informado
que la transferencia al hígado de la sintasa del óxido nítrico
neuronal en ratas cirróticas mejora la hipertensión
portal.20 En otro estudio interesante, Uesugi et al. propusieron
que la inhibición del NF-κB mediante el envío de
su represor el IκB reduce lesión temprana en ratas inducida
por alcohol.21 Además, un vector adenoviral que
codifi ca para hiper-IL-6 (una citosina superagonista diseñada
que consiste en IL-6 humana ligada por una cadena
peptídica fl exible para ser secretada en forma de receptor
de IL-6) fue capaz de mantener la función hepática,
prevenir el avance de necrosis e inducir regeneración en
un modelo murino de daño hepático agudo inducido por
administración de D-galactosamina.22 Nuestro grupo
CONSIDERACIONES DE INTERÉS
Hay otro punto importante que se relaciona con él cuando
desactiva el mensaje. El antisentido de una hebra de
DNA seguirá participando en la destrucción de mensajeros.
De igual modo, la ribozima seguirá destruyendo al
mensajero; sin embargo, se presenta una degradación de
ambos sistemas. En este caso, lo importante es que se
pueda mantener por más tiempo la inhibición del mensaje.
Los dúplex de DNA-DNA son más débiles que los
de RNA-RNA, y se ha intentado diseñar un DNA que se
parezca más a un RNA.
NUEVAS ESTRATEGIAS
En casos de translocaciones, lo ideal es atacar a la nueva
proteína oncógena resultante de la fusión de dos secuencias
no oncogénicas. El problema en estos casos es que
el punto de rotura parece estar inaccesible. Otro punto
en contra es que después que se lleva a cabo este intercambio
de secuencias a tiempos más largos, cada célula
madre se divide y también engendra una célula de la hija
que posee el cambio, propagando muy rápido este defecto
en el genoma![206841ddc13567b83b862f1b54b062b1[1]](https://microbiologia6411.files.wordpress.com/2016/07/206841ddc13567b83b862f1b54b062b111.jpg?w=685)
Aplicaciones
Desde tiempos inmemoriales, la humanidad ha utilizado
a los seres vivos para su benefi cio. De diferentes maneras, a
veces por accidente y otras con gran ingenio, se han ido
descubriendo procedimientos para obtener mejoras en
las variedades animales y vegetales. La revolución agrícola,
la domesticación de animales y la producción de vino,
cerveza y yogur no son sino diversas manifestaciones de
la biotecnología.1
La biotecnología se ha defi nido como la aplicación de
organismos, sistemas y procesos biológicos en las industrias
manufactureras y de servicios. Sin embargo, la biotecnología
moderna es la que se sirve de las técnicas del
DNA para realizar mejoras en los seres vivos, con miras a
su utilización. La biotecnología no existe como una disciplina
científi ca, sino más bien como una amplia variedad
de áreas temáticas. Sus frutos han nacido de un árbol
cuyas raíces son las ciencias biológicas, en particular la
microbiología, la genética, la biología molecular y la bioquímica.
Parece que esta palabra se utilizó por primera vez al
comienzo del decenio de 1920 por el Leeds City Council
del Reino Unido, cuando sus miembros fundaron un
Instituto de Biotecnología. No obstante, los procesos biotecnológicos
son anteriores a esta fecha; datan de hace
unos 5000 años, cuando se descubrió la producción de
bebidas alcohólicas por fermentación. Los antiguos egipcios
fueron tan lejos en aquel tiempo que incluso utilizaron
pan mohoso como cataplasma para curar las heridas
infectadas e introdujeron un servicio para detectar la gestación
basado en el efecto de la orina en la velocidad de
germinación del trigo.
El término biotecnología se ha introducido en fecha
reciente en el lenguaje popular como resultado del gran
potencial resultante de la aplicación de las técnicas de
biología molecular. Por otra parte, el avance más signifi
cativo de esta última ha sido tal vez el desarrollo de la
reacción en cadena de la polimerasa (PCR, por sus siglas
en inglés). La aparición de la PCR ha revolucionado todas
las áreas de investigación científi ca, hasta el punto de
convertir en rutina automática multitud de procesos que
antes requerían procedimientos artesanales e imprecisos.
Con ella, en pocos años, la promesa de que la biotecnología
podía llegar a constituir un éxito comercial se ha convertido
en realidad. Asimismo, la relativamente recién
aparecida manipulación genética in vitro ha ampliado el
número de productos susceptibles de ser generados por
los microorganismos y ha proporcionado nuevos métodos
para incrementar el rendimiento en la obtención de
los ya existentes.
Asimismo, la tecnología del DNA recombinante ha
supuesto un impacto signifi cativo en la industria, debido
a la posibilidad ilimitada de separar un gen o una secuencia de DNA de cualquier fuente y transferirlo a otro
organismo, de modo que éste sea capaz de replicarse y
transmitirse a la descendencia. Esta secuencia puede ser
un gen que codifi que para un producto comercialmente
útil, que se transfi ere a especies en las cuales puede ser
sintetizado de manera efi caz y económica, o una nueva
característica para el microorganismo hospedador.2
Los elementos esenciales de la técnica del DNA recombinante
son: 1) La obtención de fragmentos específi cos
de DNA (enzimas de restricción). Las endonucleasas de
restricción constituyen una herramienta de valor incalculable
para fragmentar el DNA en sitios específi cos, ya
que reconocen una secuencia específi ca, la cual difi ere
para distintas especies y cepas.3 2) Ligación o reasociación
covalente. Para reasociar dos moléculas de DNA, es
necesario reconstituir un enlace fosfodiéster; aquí entra
en acción una enzima llamada ligasa de DNA. 3) Mecanismo
para introducir en el organismo el DNA recombinante
(transformación). 4) Mecanismo para asegurar la
replicación e identifi cación de la molécula recombinante
dentro de la célula. Si queremos que el DNA transferido
sea capaz de replicarse, debe ser ligado a una molécula
susceptible de multiplicación en la célula hospedadora.
Se requiere una molécula pequeña que además posea la
capacidad de replicación autónoma (es decir, independiente
del cromosoma). A estas moléculas se les denomina
vectores. En la naturaleza hay dos clases de vectores:
los plásmidos (moléculas de DNA extracromosómico que
se encuentran en forma de múltiples copias en muchas
especies bacterianas4 y por lo general no son necesarios
para la viabilidad de la célula, aunque pueden transportar
algunos genes, como los que confi eren resistencia a antibióticos),
y los virus bacterianos o fagos, los cuales pueden
replicarse dentro de una bacteria y originar muchas
moléculas idénticas. Las moléculas ligadas se introducen
a las células hospedadoras, y se seleccionan por medio
de genes marcadores presentes en el vector de clonación.
Dentro de su secuencia, los vectores de clonación contienen
señales que inducen la replicación del DNA.
Actualmente, con la introducción de la PCR por Kary
Mullis en 1983, las enzimas de restricción y las técnicas
de secuenciación e hibridación, las secuencias de un único
gen pueden ser localizadas, entre una abundancia de
otras secuencias, cortadas en sitios específi cos y amplifi
cadas de modo exponencial hasta rendir una cantidad
analizable. La PCR ha incrementado las posibilidades que
ofrece la tecnología del DNA, ya que permite la amplifi –
cación de secuencias de DNA específi cas sin la necesidad
que sea clonado en células.
El presente capítulo pretende mostrar en qué forma
la biología molecular ha proporcionado el mayor impulso
en el desarrollo de la biotecnología y describir la manera
como puede ser utilizado el potencial de estas técnicas en
la obtención de productos o procesos útiles para el hombre
en algunas de las áreas en las que ha tenido mayor
impacto, como la industria farmacéutica y agroalimentaria.
INDUSTRIA FARMACÉUTICA Y SALUD
El surgimiento de la ingeniería genética y su impresionante
desarrollo a la fecha ha permitido iniciar el análisis
a fondo de la estructura y mecanismo de acción del
programa genético de un ser vivo. Las aplicaciones
de este nuevo conocimiento han consolidado el origen de
una nueva medicina que busca conocer las bases moleculares
de la salud y la enfermedad. La medicina actual
utiliza con éxito la tecnología genética que permite la
producción de proteínas recombinantes necesarias para
el diagnóstico y tratamiento de enfermedades genéticas
e infecciosas y para la elaboración de nuevas vacunas. El
uso de estas metodologías también ha tenido efecto en
el diagnóstico y tratamiento de trastornos hereditarios y
pronto ofrecerá un nuevo tipo de terapia para introducir
genes sanos a células con genes defectuosos dentro de
nuestro cuerpo.5
La aplicación comercial de la tecnología del DNA
recombinante se inició a fi nales del decenio de 1970
con la producción de proteínas con el objeto de utilizarlas
como agentes terapéuticos. Hoy en día, mediante las
técnicas de biología molecular, han aparecido infi nidad
de agentes terapéuticos nuevos basados en anticuerpos
obtenidos mediante ingeniería genética, tecnología antisentido
y otros productos y terapias génicas. No obstante,
las proteínas terapéuticas son las que han alcanzado el
mayor impacto en su uso. Además, se ha conseguido su
síntesis a cantidades requeridas para su uso terapéutico.
Ejemplos típicos son: la transferencia a Escherichia coli
del gen de la insulina humana, utilizada en el tratamiento
de la diabetes;6 los genes del interferón, para enfermedades
víricas y en combinación con otros agentes en el
tratamiento de diferentes tipos de cáncer;7 el mensajero
de la hormona de crecimiento humano, en el tratamiento
del enanismo hipofi sario;8 la eritropoyetina, que estimula
la producción de eritrocitos y se usa en el tratamiento de
anemias agudas o relacionadas con tratamientos terapéuticos,
y el factor estimulante de la colonia mieloide, para
complementar la terapia anticancerosa y en los trasplantes
de médula ósea.
Tan pronto como los biólogos moleculares comenzaron
a satisfacer las necesidades de proteínas auténticas
y puras, comenzó la demanda de derivados no auténticos.
Con las herramientas de clonación, secuenciación y
expresión de proteínas, se empezaron a preparar derivados
proteínicos con secuencias aminoacídicas alteradas
denominadas muteínas. Éstas son proteínas con actividad
biológica nueva o mejorada, que sirven para estudiar
el modo de acción y el papel fi siológico de algunas sustancias.
9 Entre los ejemplos de muteínas que se han evaluado
en estudios clínicos o en modelos de enfermedad
Medicina forense
La determinación de las huellas dactilares genéticas
constituye otra aplicación de las técnicas moleculares,
de modo específi co la PCR y las enzimas de restricción.
Estas técnicas se aplican en la actualidad en medicina
forense e investigaciones policiales con el fi n de identifi –
car individuos a partir de muestras biológicas, como sangre,
semen, saliva, piel, cabellos, encontrados en casos de
muerte, violación, y otro tipo de agresiones. El perfi lado
de DNA permite la identifi cación de tales evidencias con
un grado de certeza que antes se consideraba imposible,
ya que es posible comparar muestras diferentes de DNA
para comprobar si pertenecen a un individuo o no, o si
hay parentesco entre ellos. De manera similar, la técnica
puede suministrar pruebas evidenciales en caso de paternidad
reclamada o no reconocida.16
Vacunas
La vacunación contra las enfermedades bacterianas y
víricas ha sido uno de los grandes éxitos de la historia
de la medicina humana y veterinaria. El ejemplo más
signifi cativo de la efi cacia de la vacunación tal vez es la
erradicación de la viruela. A pesar del tremendo progreso
conseguido, las enfermedades contagiosas son todavía el
gran problema de la humanidad. Más de 10 millones de
muertes al año en todo el mundo se deben a enfermedades
infecciosas.17
Las vacunas son la vía más simple y económica para
reducir los costos que provocan las enfermedades infecciosas. La manipulación genética proporciona nuevas técnicas
para abordar el problema de diferentes maneras.
Hay dos estrategias clásicas para la vacunación. Una
de ellas consiste en la vacunación con microorganismos
patógenos muertos o con subunidades de éstos. La otra
utiliza virus o bacterias vivas atenuados que no causan la
enfermedad, pero proceden de un microorganismo patógeno.
La utilización de microorganismos manipulados
genéticamente representa una alternativa atractiva para
la producción de vacunas. El objetivo que se persigue
al producir una vacuna es que contenga moléculas que
produzcan la misma respuesta antigénica, sin causar la
proliferación nociva del patógeno en el organismo. Esto
se logra mediante virus que de alguna manera se transforman
en apatógenos. Ayudados de las técnicas de biología
molecular, existe la posibilidad de clonar y expresar en
bacterias los genes de las proteínas de la envoltura vírica,
utilizando el producto bacteriano como vacuna.18
Las vacunas habituales destinadas a enfermedades
infecciosas en seres humanos más comunes son difteria,
tétanos, tos ferina, poliomielitis, sarampión, paperas,
rubéola etc.; hay también otras vacunas para circunstancias
especiales, por ejemplo la vacuna del cólera, fi ebre
amarilla, encefalitis japonesa, hepatitis B, etcétera.
Existen vacunas también satisfactorias desde el punto
de vista de la medicina veterinaria: peste bovina, fi ebre
aftosa, enfermedades producidas por Clostridium spp.,
enfermedades de Newcastle y Marek, contra enfermedades
en animales.
Para algunos patógenos cuyo cultivo in vitro es difícil,
como es el caso del virus de la hepatitis B, el agente
de la sífi lis humana (Treponema pallidum) y la bacteria
que causa la lepra (Mycobacterium leprae), la tecnología
del DNA recombinante permite la transferencia de la
información genética desde el microorganismo patógeno
a otros hospedadores más manejables como E. coli, levaduras
o células de mamíferos que hacen posible la obtención
de vacunas vivas atenuadas o inactivadas.1
INDUSTRIA ALIMENTARIA
En la industria de los alimentos, el pan y los quesos son
sólo dos de los alimentos incluidos con ciertas manipulaciones
genéticas, que están disponibles para el consumidor.
Las levaduras se han utilizado desde la antigüedad
en las fermentaciones alimentarias en la masa del pan
y en la producción de bebidas fermentadas. El conocimiento
de la genética y la bioquímica de las levaduras ha
conducido al desarrollo de nuevas cepas mediante técnicas
moleculares.19
En levaduras, la producción de nuevas cepas con crecimiento
rápido y alto rendimiento tiene un valor potencial;
en la elaboración del pan, se han conseguido nuevas
cepas de crecimiento rápido y con buena producción de
dióxido de carbono.20
En la industria de bebidas se han provisto ciertos
cambios, mediante el clonado de levaduras en muchas
enzimas, para la producción de cervezas más ligeras gracias
a la actividad más efi ciente de la amilasa, el control
de los sabores no deseados debidos a la producción de
diacetilos y fenoles, mejoramiento en la fi ltrabilidad gracias
a una reducción de glucanos β residuales, así como
mejoras en la calidad de almacenamiento mediante el
control de la humedad.21
De la misma manera, se puede prever una serie de
mejoras para los productos lácteos, como la capacidad
para producir ácidos estables y facilitar la hechura del
queso, en la producción de intensifi cadores del sabor y
textura del queso y en la aceleración de la maduración.
En la actualidad, están bajo pruebas comerciales algunas
cepas nuevas producidas a través de técnicas no
recombinantes, como Lactobacillus casei spp. ramosum
GG, con capacidad de unirse a las células por la mucosa
intestinal humana, estabilidad a ácidos y sales biliares,
producción in vitro de una sustancia antimicrobiana. Su
utilidad reside en la producción de una bebida de suero
fermentado y un producto tipo yogur, ideados con el fi n
de promover la salud humana, ayudando al control de la
diarrea y el estreñimiento.22
Con respecto a los alimentos que hacen uso de microorganismos
lácticos producidos por técnicas de DNA
recombinante, se pueden mencionar los quesos que utilizan
la enzima quimosina (encargada de la coagulación de
la leche), el principal componente del cuajo de ternera,
producida por tres microorganismos transgénicos diferentes
Kluveromyces lactis, Aspergillus niger variante
awamori y E. coli K-12. Esta enzima ha demostrado ser
idéntica a la producida por terneras.23 La quimosina producida
a partir de microorganismos transgénicos con respecto
al cuajo puede ser recogida más rápido, contener
una concentración mayor de enzima activa y producir
quesos con propiedades de textura y aroma controlables;
además, el incentivo para su producción reside en la economía.
Hay muchos procesos en la industria alimentaria, los
cuales pueden ser susceptibles a la utilización de enzimas,
lo cual representa un campo potencial en la modifi –
cación genética de especies de microorganismos, con el
fi
n de mejorar su estabilidad, especifi cidad y producción.
Plantas
Las plantas, aparte de la provisión de alimentos, son
también una fuente importante de materia prima. Las
plantas constituyen también una fuente relevante de
medicamentos valiosos.
El estudio de las plantas, desde el punto de vista molecular,
ha estado rezagado respecto a otros microorganismos.
La tecnología del DNA recombinante no tuvo en el
área de las plantas un impacto tan inmediato como en
el área de la salud. Esta situación ha cambiado en los
últimos años. Muchos grupos de investigación han detectado
la importancia de aplicar estas técnicas a la biología
vegetal y el gran potencial que tiene la manipulación de
las plantas. La posibilidad de realizar ingeniería genética
en plantas depende, al igual que en los microorganismos
Transducción de señales
Transducción de señales
En el mantenimiento de la homeostasia, las células que
forman parte de un tejido responden a señales extracelulares,
regulando el metabolismo de la célula con un solo
fi n: mantener vivo al organismo del cual forman parte.
Para este propósito, la célula regula sus actividades enzimáticas
y vías metabólicas induciendo a la célula a:
• Modifi car su expresión génica.
• Secretar moléculas.
• Fagocitar partículas.
• División celular.
• Apoptosis.
• Diferenciación celular.
• Procesos de migración.
Estos procesos son inducidos por moléculas que en
una célula pueden tener un efecto, por ejemplo: inducir
la proliferación celular, pero en otra un efecto totalmente
contrario, inhibirla. Esto indica que en la respuesta
celular están incluidos no sólo los ligandos y receptores,
sino también una serie de segundos mensajeros y proteínas
reguladoras, que en el citosol y núcleo forman una
compleja red de señales y vías intracelulares, muchas de
las cuales llegan hasta el núcleo, modifi cando la expresión
génica mediante factores transcripcionales.
En este capítulo se analizan ejemplos de las vías de
transducción que comprenden procesos, como proliferación
celular inducida por factores de crecimiento, citocinas
que producen infl amación y el factor transcripcional
clásico, en este proceso NF-κB, además de proteínas G y
señales de cicatrización.
TIPOS DE SEÑALES CELULARES
Las células se comunican y responden a su microambiente
mediante moléculas que se secretan a su entorno,
como: a) hormonas y citocinas, b) moléculas de adherencia
y componentes de la matriz extracelular y c)
neurotransmisores. Las hormonas y citocinas actúan a
concentraciones muy bajas, por lo general ≤ 10−8 M, y sus
correspondientes receptores presentan una alta afi nidad
por su ligando con una constante de afi nidad Ka >108 L/
mol. Las formas en que se transmiten las señales celulares
se clasifi can según la distancia en que éstas llegan
a su célula blanco. Las señales endocrinas son aquellas
que se secretan por una estirpe celular hacia el torrente
circulatorio y actúan a distancia sobre células blanco. En
esta categoría se encuentran las hormonas. Como ejemplo
está el glucagon, hormona producida por las células
α del páncreas, secretada al torrente circulatorio y con
un efecto en hepatocitos. El glucagon estimula la degra-
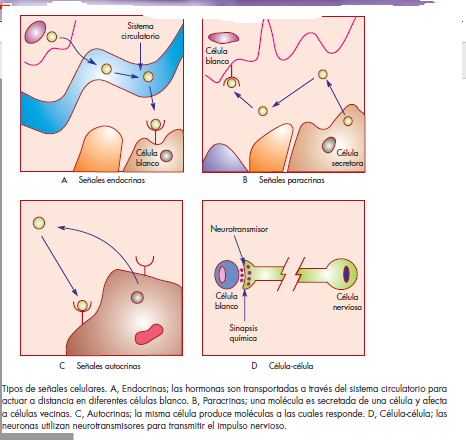
Síntesis de proteínas
Síntesis de proteínas
Las proteínas, por su tamaño, no pueden atravesar la
membrana plasmática de la célula; por eso, existe en su
interior un mecanismo que las construye (síntesis) según
las necesidades que tenga en ese momento la célula.
La síntesis de proteínas o traducción tiene lugar en
los ribosomas del citoplasma celular. Los aminoácidos
son transportados por el RNA de transferencia (RNAt),
específi co para cada uno de ellos, y llevados hasta el RNA
mensajero (RNAm), donde se aparean el codón de éste y
el anticodón del RNA de transferencia, por complementariedad
de bases, y de esta manera se sitúan en la posición
que les corresponde.
Cuando termina la síntesis de una proteína, el RNAm
queda libre y puede leerse de nuevo. De hecho, es muy frecuente
que antes que fi nalice una proteína, se inicia la lectura
para otra, con lo cual una misma molécula de RNAm
es utilizada por varios ribosomas simultáneamente.
Este proceso es de fundamental importancia, ya que
básicamente todas las características que presenta la
célula (fenotipo) se regulan por la suma de sus actividades
enzimáticas. En pocas palabras, todo lo que la célula
es y puede realizar depende de la acción enzimática
específi ca. Como casi todas las enzimas son proteínas,
la morfología y funcionamiento celular depende del tipo
de proteína que la célula debe armar. Con el transcurso
de la evolución, todos los organismos se aseguraron
que la información correspondiente para sintetizar sus
enzimas específi cas esté presente en sus células y en su
descendencia.
CARACTERÍSTICAS DEL RNAT
La síntesis del RNAt se realiza a través de la catálisis de
la polimerasa del RNA III tal y como se vio en el capítulo
de transcripción. Éste se encuentra disperso por todo el
citoplasma; es el más pequeño de los tres tipos de RNA
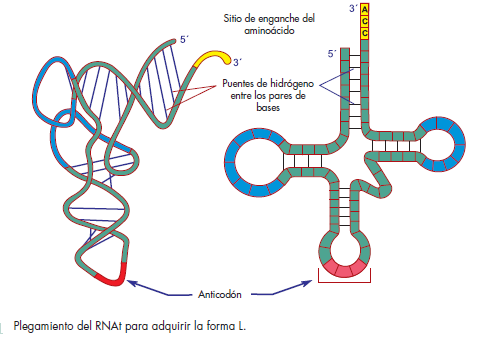
y su estructura tiene forma de hoja de trébol. Los RNAt
se estructuran por alrededor de 80 nucleótidos con pesos
moleculares de cerca de 25 000 daltones (fi g. 6-1).
Todos los RNAt tienen pG en el extremo 5′ y pCpCpA
en el extremo 3′. El extremo 3′ se conoce como brazo del
aminoácido o también brazo de unión al aminoácido o
“aceptor”. El correspondiente brazo del anticodón contiene
el triplete anticodón, el cual reconoce el codón del
RNAm y se relaciona con éste por medio de formación
de puentes de hidrógeno, siguiendo las reglas de complementariedad
de las bases.
Cada tipo de RNAt lleva antepuesto el nombre del
aminoácido que transporta. Por ejemplo, leucinil-RNAt
para la leucina, lisinil-RNAt para la lisina, fenilalanil-
RNAt para la fenilalanina, metionil-RNAt para la metionina,
etcétera. Sin embargo, para poder efectuar esta unión
y reconocimiento específi co del RNAt con su respectivo
aminoácido, se necesita la participación de una enzima

AMINOACILSINTETASA
Es la enzima que cataliza la activación y la unión del aminoácido
correcto al RNAt correcto. Son doblemente específi
cas por reconocimiento molecular:
1. Para cada aminoácido: reconocen propiedades de carga,
hidrofobicidad y tamaño.
2. Para cada RNAt correspondiente: interactúan específi
camente con el brazo aceptor y con el brazo del
anticodón (fi g. 6-2).
3. Conocen e interpretan el código genético.
Así, son capaces de corregir errores, pues contienen
sitios especiales de “revisión”; si el aminoácido es incorrecto,
se hidrolizan del RNAt y tienen alta fi delidad.
Existen 20 aminoacilsintetasas de RNAt diferentes,
cada una específi ca para reconocer a un aminoácido y al
RNAt compatible con él. Ambos reconocimientos permiten
que cada uno de los 31 tipos de RNAt se una a sólo
uno de los 20 aminoácidos utilizados durante la síntesis
proteínica. Ello es posible porque cada aminoacilsintetasa
de RNAt identifi ca al RNAt por el anticodón, la parte
más específi ca del RNAt.
ACTIVACIÓN Y UNIÓN
DEL AMINOÁCIDO AL RNAT
Los aminoácidos se activan por medio de las aminoacilsintetasas
específi cas y de ATP, antes de unir los aminoácidos
a su RNAt específi co.
Los aminoácidos, una vez activados, forman el complejo
aminoaciladenilato monofosfatado, liberando el
pirofosfato, producto secundario del ATP (fi g. 6-3). La
misma enzima aminoacilsintetasa localiza al RNAt específi
co para el aminoácido correspondiente y da lugar a
la formación del aminoacil-RNAt, liberándose la enzima
para reiniciar otro ciclo con otro aminoácido similar.

MADURACIÓN Y/O PREPARACIÓN
DEL RNAT PARA UNIRSE
AL RIBOSOMA
El trabajo de los RNAt consiste en tomar del citosol los
aminoácidos y conducirlos al ribosoma en el orden marcado
por los nucleótidos del RNAm, que son los moldes
del sistema.
Así, la función básica de los RNAt es alinear a los aminoácidos
siguiendo el orden de los codones para poder
cumplir con sus funciones; los RNAt adquieren una forma
característica semejante a un trébol de cuatro hojas. Los
cuatro brazos se generan por la presencia en los RNAt de
secuencias de tres a cinco pares de nucleótidos complementarios,
los cuales se aparean entre sí como los
nucleótidos de las dos cadenas del ácido desoxirribonucleico
(fi g. 6-5).
En la punta de uno de los brazos confl uyen los extremos
5′ y 3′ del RNAt. El extremo 3′ es más largo, de modo
que sobresale el trinucleótido CCA que fue incorporado
durante el procesamiento postranscripcional del RNAt.
Este brazo se llama aceptor, porque a él se liga el aminoácido,
que se une a la A del CCA.
Los tres brazos restantes poseen en sus extremos
secuencias de 7 a 8 nucleótidos no apareados, con forma
de asas, cuyas denominaciones derivan de los nucleótidos
que las caracterizan. Una de ellas contiene el triplete
de nucleótidos del anticodón, por lo que su composición
varía en cada tipo de RNAt. Otra, en virtud de que contiene
dihidrouridinas (D), se denomina asa D. La tercera
se conoce como asa T, por el trinucleótido TΨC que la
identifi ca. La letra T simboliza a la ribotimidina y la Ψ a
la seudouridina.
Entre el asa T y el anticodón, existe un asa adicional
llamada variable, porque su longitud difi ere en los distintos
RNA de transferencia.
INICIACIÓN DE LA SÍNTESIS
DE PROTEÍNAS
Procariontes
Se comienza con la subunidad menor sola. IF-1 se une
a la base del sitio A para forzar que el primer fMet-RNAt
entre en el sitio P. IF-3 tiene una doble función, ya que se
le necesita para estabilizar la subunidad 30S y para que
el RNAm interaccione con dicha subunidad. IF-2 (como
otros muchos factores de traducción) es del tipo de proteínas
G que sirve para depositar el aminoacil-RNAt
(fMet-RNAt en este caso) en el ribosoma.
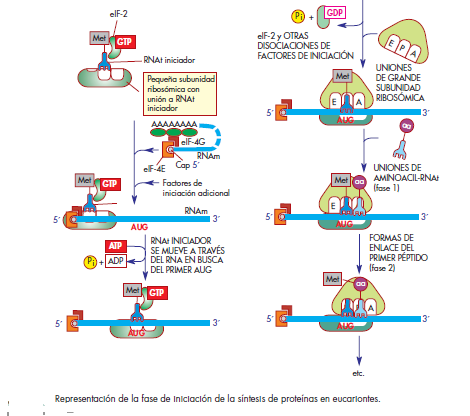
.
Transcripción
Regulación de la transcripción
La información genética de una célula está contenida en su DNA. El DNA contiene la información necesaria para crear miles de moléculas diferentes y con ello conforma un individuo completo. Un organismo procarionte como una bacteria, consta de millones de nucleótidos, en tanto que uno eucarionte, como el humano, cuenta con varios billones. A pesar de contener toda esa información, la célula expresa sólo una fracción de sus genes, lo que le da un fenotipo característico, de tal modo que cada uno de los 10 000 tipos de células que constituyen a los organismos  multicelulares expresan genes diferentes. Aunque los diversos tipos de células en un organismo multicelular contienen la misma información genética, difieren ampliamente en estructura y función. Una neurona y un linfocito por ejemplo son muy diferentes, por lo que sería difícil pensar que estas dos células contienen el mismo genoma como sucede en realidad. Por esta razón, se pensaba que los genes se perdían cuando las células se diferenciaban. Ahora se sabe que las células de un organismo multicelular son distintas porque sintetizan diferentes RNAm y por ende diferentes proteínas a partir del mismo genoma.
multicelulares expresan genes diferentes. Aunque los diversos tipos de células en un organismo multicelular contienen la misma información genética, difieren ampliamente en estructura y función. Una neurona y un linfocito por ejemplo son muy diferentes, por lo que sería difícil pensar que estas dos células contienen el mismo genoma como sucede en realidad. Por esta razón, se pensaba que los genes se perdían cuando las células se diferenciaban. Ahora se sabe que las células de un organismo multicelular son distintas porque sintetizan diferentes RNAm y por ende diferentes proteínas a partir del mismo genoma.
REGULACIÓN DE LA EXPRESIÓN GÉNICA
Uno de los principios fundamentales de la biología celular
es que la actividad y propiedades de cada célula están
determinadas por las proteínas que contienen. Pero,
¿qué determina los tipos y la cantidad de proteínas que
se encuentran en una célula? ¿Qué determina la frecuencia
con que los RNAm son traducidos y la estabilidad de
las proteínas?
El término expresión génica se refi ere al proceso
mediante el cual la información codifi cada en un gen es
traducida en una proteína. Aunque la expresión de un
gen puede regularse a diferentes niveles desde su transcripción
a partir del DNA, hasta la formación de una
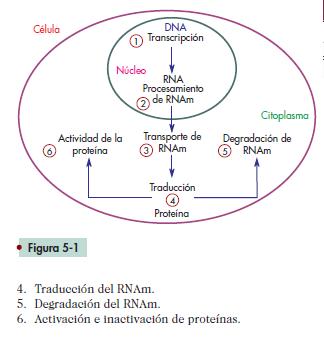
proteína madura y activa (fi g. 5-1), el mayor punto de
control se da a nivel de la transcripción. Sin embargo, la
expresión génica puede ser regulada en cualesquiera de
los siguientes niveles:
1. Transcripción.
2. Procesamiento del transcrito primario de RNA.
3. Transporte del RNAm al citoplasma.
CONTROL TRANSCRIPCIONAL
La primera evidencia de que había proteínas reguladoras
fue descubierta en 1950. Al realizar análisis genéticos
en bacterias, se observó que ciertas proteínas se unían
a secuencias específi cas del DNA y que esta unión era
necesaria para la activación e inactivación de genes.
Control transcripcional en procariontes
En las bacterias, el control de la transcripción está dado
principalmente por los cambios en el ambiente donde se
encuentran, lo que determina su crecimiento y proliferación.
Aunque en organismos multicelulares la expresión
de algunos de sus genes es también controlada por
la disponibilidad de alimento, en la mayoría de ellos el
proceso de la transcripción es regulado por programas
genéticos que controlan su desarrollo embrionario y la
diferenciación celular. Muchos de los principios de regulación
transcripcional se descubrieron en las bacterias y
se aplican también a células eucariontes.
.
Control transcripcional en eucariontes
La transcripción génica es controlada por una región de
DNA ubicada cerca del sitio de inicio de la transcripción
a la que se le llama región reguladora. Algunas regiones
reguladoras son sencillas y constan de un fragmento
pequeño de DNA de secuencia defi nida; estas regiones
están regidas por una sola señal y actúan controlando la
actividad de los genes. Otras son complejas, responden a
una variedad de señales y actúan como pequeños microprocesadores
que interpretan e integran el “encendido
y apagado” de genes vecinos. La transcripción es controlada
por proteínas especializadas llamadas proteínas
reguladoras de un gen o factores transcripcionales.
Un mismo factor transcripcional puede servir como controlador
común a muchos genes al mismo tiempo. Esto
se debe a que todos ellos comparten la misma secuencia
en su promotor, la cual es reconocida por el factor transcripcional.
Las proteínas reguladoras se unen a secuencias específi
cas de DNA de aproximadamente 20 pares de nucleótidos
de longitud cerca de los genes que regulan. El
reconocimiento entre la proteína y el DNA se realiza a
través del surco mayor y se debe a que la estructura de
la proteína es complementaria a la superfi cie espacial
de la doble hélice; la proteína hace contacto con el DNA
Activación e inactivación de genes
La regulación de la transcripción en eucariontes es muy
compleja y difi ere de la de procariontes, principalmente
en los siguientes pasos:
a) La polimerasa del RNA eucarionte no puede iniciar
por sí misma la transcripción; requiere de un grupo de
proteínas reguladoras llamadas factores generales de
la transcripción, las cuales se ensamblan al DNA en
un sitio llamado promotor, localizado corriente arriba
del sitio de inicio de la transcripción. El ensamblaje
de los factores generales consta de varias etapas en
donde la velocidad depende de las señales reguladoras
que se reciban.
b) La mayoría de los factores transcripcionales actúa a
miles de bases de distancia del promotor que regulan,
lo que signifi ca que un promotor puede ser controlado
por un número ilimitado de secuencias reguladoras
localizadas a lo largo de la cadena del DNA.
Factores generales de transcripción
El hallazgo de que la polimerasa del RNA eucarionte por
sí sola no puede iniciar la transcripción condujo al descubrimiento
de proteínas adicionales conocidas como
factores generales de la transcripción.
Estas proteínas, conocidas como TFIIA, TFIIB, TFIID,
TFIIE, TFIIF, TFIIH y TFIIJ (por sus siglas en inglés transcriptional
factor, TF y II por estar asociadas a la polimerasa
del RNA II), se ensamblan en el promotor de los
genes de manera coordinada asistiendo la unión y acción
de la polimerasa del RNA. El ensamblaje se inicia con
la unión del factor transcripcional TFIID a la secuencia
TATA en el promotor (formada por dos tipos de proteínas
diferentes: TBP y TAF, TATA binding protein y TBP asociates
factors, respectivamente). Después se incorporan
los factores TFIIA y TFIIB y sólo entonces la polimerasa
de RNA II acomplejada con el TFIIF puede unirse al promotor.
TFIIE, TFIIH y TFIIJ se acoplan después a este
complejo. Una vez reunidos todos estos elementos, TFIIE
con su acción de helicasa desenrolla el DNA y TFIIH
EDICIÓN DEL RNA
Este tipo de control postranscripcional se refi ere a la
modifi cación debida a inserciones o eliminaciones de
nucleótidos en la secuencia original del RNAm, provocando
cambios en el mensaje original. La modifi cación
más frecuente es la inserción del uracilo, con lo que se
altera hasta 50% la secuencia original.
En mitocondrias de plantas, se han observado cambios
de citocinas por uracilo (C a U) sin inserción o eliminación
de nucleótidos, afectando sólo 10% de la secuencia
de aminoácidos de las proteínas formadas a partir
de estos RNAm. El descubrimiento de este mecanismo de
edición ha permitido sugerir que es la herramienta más
utilizada por la célula para cambiar la expresión de los
genes.
El proceso de edición del RNAm es limitado en mamíferos
y sólo se ha observado en los genes de la ApoB y
de la proteína de canal del calcio en el cerebro. En el
primer caso, una citocina se cambia por un uracilo, generando
un codón de terminación prematuro que produce
una versión truncada de la proteína; en el segundo caso,
se cambia un nucleótido a la mitad de la molécula del
RNAm. Esto origina el reemplazo de un aminoácido por
otro, lo que altera la permeabilidad del canal del calcio.
Control del transporte de RNA
Transporte del núcleo al citoplasma
El RNA transcrito primario es aproximadamente 10 veces
más grande que el RNAm maduro que sale al citoplasma.
Se estima que sólo 20% de la longitud del RNA sintetizado
sale del núcleo; el resto (80%) es degradado en el núcleo
antes de salir. El RNA como cualquier otra molécula sale
del núcleo a través del poro nuclear; se trata de un proceso
activo que requiere de un nucleótido modifi cado que
sirve como cubierta en el extremo 5′ de la molécula y de
la adición de una cadena de adeninas en el extremo 3′
(poliadenilación) llamada cola de poli A.
Cuando una molécula de RNAm recién sintetizada
cruza por un poro nuclear y se introduce al citoplasma,
se encuentra con los ribosomas, los cuales la traducen en
una cadena polipeptídica. Si el RNAm codifi ca para una
proteína de secreción o de membrana, la presencia de un
péptido, señal en la región aminoterminal determina su
transporte hacia el retículo endoplásmico. Este péptido
es reconocido por la célula tan pronto sale del ribosoma
y entonces el complejo formado por el ribosoma, el
RNAm y la proteína naciente se dirigen a la membrana
del retículo endoplásmico, donde la cadena polipeptídica
terminará de sintetizarse. En otros casos, la proteína
entera es sintetizada por ribosomas libres en el citosol, y
señales en su estructura la dirigen al sitio en la célula en
donde se necesita. Asimismo, algunos RNAm se dirigen a
ciertos organelos para sintetizar ahí las proteínas propias
del mismo.
Control de la traducción
Sitio de inicio
La traducción comienza cuando la subunidad pequeña
del ribosoma reconoce el codón de iniciación en el
RNAm. Los nucleótidos vecinos participan en este reconocimiento.
Si éste es defi ciente, la subunidad ribosómica
Cuadro 5-1 Modifi caciones postranscripcionales
Atenuación de la transcripción Terminación prematura de la transcripción, ocasionada por interacción con la
polimerasa del RNA
Control del procesamiento del RNA Retiro de intrones del RNAm precursor; incluye también el corte y empalme
alternativo
Edición del RNA corte y empalme Inserción o eliminación de nucleótidos del RNAm; la modificación más frecuente es la
adición de un uracilo
Control del transporte del RNA El paso del RNAm por el poro nuclear al citoplasma implica que se ha modificado
adecuadamente
Control de la traducción El reconocimiento del codón de inicio de la traducción puede ser deficiente
generando orígenes alternativos
Fosforilación en la síntesis de proteínas El factor de iniciación de la traducción del IF2 es regulado por fosforilaciones
Proteínas inhibidoras de la traducción Proteínas que se unen al extremo 5’ del RNAm bloqueando la traducción
Control de la degradación del DNA Colas de poli A menores a 30 Nt inducen la degradación del RNA
Mecanismos de fosforilación en la síntesis de proteínas 69
ignorará el primer codón AUG y saltará hasta el segundo
o tercero. Este fenómeno, conocido como búsqueda de
escape, es una estrategia para producir dos o más proteínas,
diferentes en su extremo aminoterminal a partir de
un mismo RNAm.
En RNAm virales, se realiza la traducción usando este
tipo de mecanismos. Estos RNAm cuentan con secuencias
de nucleótidos específi cas llamadas sitios internos,
las cuales no son reconocidas por el ribosoma, y la traducción
se inicia en el segundo codón AUG.
MECANISMOS DE FOSFORILACIÓN
EN LA SÍNTESIS DE PROTEÍNAS
Otro mecanismo por el cual se puede regular la expresión
de un gen es mediante fosforilaciones. Las células eucariontes
disminuyen la síntesis de proteínas en condiciones
adversas (p. ej., carencia de factores de crecimiento,
infecciones víricas, choque térmico, etc.). En este mecanismo
de regulación, participa el factor de iniciación
EIF-2 (elongation increasing factor, EIF), el cual es fosforilado
por cinasas específi cas, con lo cual se disminuye
la síntesis de proteínas. El EIF-2 forma un complejo con
el GTP y media la unión del metionil-RNAt a la subunidad
ribosómica pequeña, facilitando el reconocimiento
del codón de iniciación. El EIF-2 hidroliza GTP y se libera
de la subunidad ribosómica pequeña. Sólo entonces
la subunidad ribosómica grande se acopla para formar el
ribosoma e iniciar la síntesis de proteínas.
Debido a que el EIF-2 se fi ja fuertemente a GDP, se
requiere otra proteína denominada EIF-2B para liberar
a GDP; otra molécula de GTP puede entonces unirse de
nuevo a la molécula del EIF-2. La fosforilación del EIF-2
bloquea el recambio de GTP; ya fosforilado el EIF-2 se
une con mayor fuerza al EIF-2B. Se esperaría que la disminución
de la actividad del EIF-2 mermara la traducción
de todos los RNAm en la misma proporción. Contrario
a esto, la fosforilación del EIF-2 tiene efectos selectivos,
incrementado la traducción del RNAm específi cos. La
regulación por el EIF-2 es importante en el paso de mitosis
a la fase Go en células de mamíferos en la cual se
minimiza la síntesis de proteínas.
Proteínas inhibidoras de la traducción
La traducción puede ser bloqueada también por proteínas
que se unen a los RNAm cerca del extremo 5′, donde
se inicia la traducción. Este tipo de mecanismo se llama
control negativo de la traducción. El acoplamiento de
tales proteínas a una molécula de RNAm disminuye o
inhibe la traducción.
Los RNAm en células bacterianas son muy inestables;
su vida media es de unos minutos. Debido a esto, una
bacteria puede adaptarse rápido a cambios ambientales.
En células eucariontes, el RNAm es más estable; por
ejemplo, el de la globina β tiene una vida media de 10 h,
cuando la de otros es de sólo 30 min. Los más inestables
codifi can a menudo para proteínas reguladoras, cuya síntesis
cambia rápidamente ante un estímulo. La inestabilidad
de estos RNAm se debe a que su secuencia es rica en
A y U en la región 3′ no traducida (UTR), lo que acelera
la degradación del RNAm por estimulación en la eliminación
de la cola de poli A. Otros RNAm inestables contienen
sitios de reconocimiento en sus extremos 3′ UTR
para endonucleasas que cortan al RNAm. Sin embargo,
la estabilidad de un RNAm puede cambiar en respuesta a
señales extracelulares. En el caso del RNAm que codifi ca
para las histonas, por ejemplo en la fase de síntesis (S)
del DNA en el ciclo celular, periodo en el que se requiere
de nuevas histonas, tiene una vida media de 1 h; cuando
la síntesis de DNA se detiene, los RNAm se inestabilizan
y son degradados en pocos minutos. Así, si la síntesis de
DNA se inhibe con algún fármaco, los RNAm de las histonas
se inestabilizan debido quizá a la acumulación de
histonas libres en ausencia de nuevos DNA. La velocidad
de degradación de los RNAm depende de manera directa de
las señales que actúan en el extremo 3′, en donde se sospecha
que comienza la degradación del RNAm.
Control de degradación del RNAm
Cola de poli A y estabilidad del RNAm
La adición de la cola de poli A a una molécula de RNAm
sucede en todos los RNAm de eucariontes, en el núcleo.
En el citosol, la cola de poli A, con una longitud promedio
de 200 nucleótidos, se va acortando con el tiempo. No se
observan colas de menos de 30 adeninas, lo que sugiere
que este es el tamaño mínimo requerido para mantener
la estabilidad del RNAm. La observación de que RNAm
con colas de sólo 10 a 30 adeninas no son traducidas apoya
esta aseveración.
Interrupción de la traducción
El proceso de síntesis de proteínas es automático; esto es,
una vez iniciado debe terminarse. En casos especiales,
un proceso llamado recodifi cación traduccional puede
alterar el curso fi nal de la síntesis de una proteína. Los
tipos de recodifi cación más observados a menudo son los
cambios en el marco de lectura. Este tipo de recodifi cación
se usa de ordinario por retrovirus, en el que más de
una proteína se sintetiza a partir de un solo RNAm. Estos
virus producen tanto las proteínas de la cápside (proteínas
gag), como la transcriptasa inversa vírica y las integrasas
(polimerasas de proteínas) del mismo transcrito.
Los virus necesitan muchas más copias de las proteínas
gag que de las polimerasas de proteínas. Para cumplir
con estas demandas, los virus hacen este ajuste cuanti70
Capítulo 5 Regulación de la transcripción
tativo al tener los genes gag y pol en marcos de lectura
abierta diferentes, asegurando con un codón de terminación
en el extremo de la secuencia codifi cadora para gag,
que sólo traduzca esta proteína.
Todos los mecanismos de control postranscripcionales
dependen del tipo de molécula de RNA, por lo que algunos
pueden ser controlados a través del procesamiento,
edición o degradación del RNAm. Dichos mecanismos se
acompañan a menudo de proteínas de unión al RNA especializadas.
En otros casos, se debe a la presencia de moléculas
de RNA complementarias al RNAm que al unirse a
él bloquean su transcripción. A este tipo de estrategias se
le conoce como RNA antisentido y se han empleado de
modo experimental para regular la expresión de algunos
genes de células procariontes y eucariontes. Los estudios
con RNA antisentido son de gran interés, ya que nos
permiten entender procesos evolutivos. Se cree que las
primeras células carecían de DNA y proteínas, y sólo contenían
RNA. Estas células primitivas utilizaban el mecanismo
antisentido para regular sus funciones.
Una buena parte de las reacciones catalizadas por
RNA que suceden en las células hoy en día representan
los descendientes de moléculas fósiles que controlaban el
metabolismo celular hace más de 3.5 billones de años. En
la actualidad, gracias a la tecnología del DNA recombinante
se pueden obtener in vitro grandes cantidades de RNA
puro de cualquier tipo que, en presencia de polimerasas
de RNA, nos permiten estudiar con detalle las reacciones
químicas catalizadas por RNA. A través de estos y más
estudios, se pretende conocer en un futuro no muy lejano
los mecanismos de regulación de la expresión génica de
las células in vivo.